Jeanne Brugère-Picoux
Professeur honoraire de pathologie médicale du bétail et des animaux de basse-cour (Ecole nationale vétérinaire d’Alfort), membre de l’Académie nationale de médecine, présidente honoraire de l’Académie vétérinaire de France

La situation évoluant rapidement, le présent article actualise le précédent, daté du 23 mai 2022.
Introduction
On assiste, depuis le 7 mai 2022, à une émergence inhabituelle de cas humains sporadiques de la variole du singe – maladie endémique jusqu’alors localisée à l’Afrique centrale et occidentale – dans plusieurs pays européens, en Amérique du Nord et en Australie. La particularité de ces cas est qu’ils concernent des personnes n’ayant pas voyagé en Afrique, à l’exception du premier malade au Royaume-Uni, qui revenait du Nigéria. Contrairement à la plupart des cas africains, pour lesquels on reconnaît une origine zoonotique, ces cas émergents sont liés à des contaminations interhumaines, souvent observées chez des hommes homosexuels ou bisexuels avec plusieurs partenaires.
Il s’agit aussi d’une zoonose et de nombreux réservoirs animaux sont suspectés en Afrique. C’est pourquoi l’apparition de cette maladie due à un virus très résistant dans le milieu extérieur en dehors de l’Afrique doit amener à une certaine prudence pour éviter tout risque d’instauration d’un réservoir animal autochtone dans ces nouveaux pays touchés par la variole du singe.
Historique
Le virus de la variole du singe a été découvert en 1958 dans un laboratoire de Copenhague chez des macaques (Macaca Fascularis) qui avaient été importés de Singapour [1]. Il y eut deux foyers à quatre mois d’intervalle. Les reins de ces singes servaient à la préparation de cultures cellulaires pour la production de vaccins contre la poliomyélite. C’est pourquoi ce nouveau virus fut dénommé Monkeypox virus (ou MPXV). D’autres laboratoires ont connu ce même problème aux Etats-Unis, aux Pays-Bas et en France [2, 3]. Il s’agissait toujours de singes captifs provenant de diverses régions tropicales (Inde, Malaisie, Philippines et Sierra Leone). Ces cas rapportés chez des singes n’ont jamais donné lieu à une contamination humaine.
Virus de la variole du singe
Il s’agit d’un Orthopoxvirus, gros virus à ADN de la famille des Poxviridae.
Il faut souligner la forte résistance dans le milieu extérieur de ce virus, en particulier à la fin de la maladie dans les croûtes cutanées.
Le terme de monkeypox pourrait changer selon l’Organisation mondiale de la Santé (OMS), qui ne souhaite plus attribuer aux virus émergents un nom discriminatoire ou stigmatisant pouvant évoquer une région géographique ou un animal. D’ailleurs on peut noter une certaine confusion lorsque l’on parle de chickenpox qui est en fait la varicelle, de smallpox pour la variole ou de cowpox pour le virus de la vaccine.
Deux souches virales sont connues pour le MPXV : un clade présent en Afrique centrale (souche Congo), le plus virulent, pouvant provoquer une mortalité de 10,6%, et un clade d’Afrique occidentale, moins pathogène avec un taux de mortalité estimé de 3,6% [4].
Une analyse métagénomique réalisée au Portugal [5] sur des prélèvements réalisés dans plusieurs pays confirme que le virus appartient au clade de l’Afrique occidentale et qu’il semble reconnaître une origine unique qui serait une souche exportée du Nigéria en 2018 et 2019.
Variole du singe chez l’Homme
Au cours des années suivant la première identification d’un cas humain en Afrique – en 1970 en République démocratique du Congo (RDC) chez un enfant de 9 mois –, la variole du singe, qui n’était plus masquée par la variole ou la vaccination, a été régulièrement observée en Afrique centrale et occidentale. Elle est devenue l’infection à orthopoxvirus la plus répandue chez l’Homme [7].
L’âge médian des malades africains est passé de 4 ans dans les années soixante-dix à 21 ans depuis 2010 [4] du fait du déclin de l’immunité collective à la suite de l’arrêt de la vaccination contre la variole qui permettait d’offrir une protection croisée estimée à 85% [9].
Lors de l’épidémie de variole du singe en Afrique de l’Ouest qui a débuté en septembre 2017 au Nigéria, quatre personnes voyageant du Nigéria vers le Royaume-Uni [10], Israël [11] et Singapour [12] sont devenues les premiers cas humains exportés d’Afrique. Il y a eu aussi une transmission nosocomiale connexe au Royaume-Uni chez un aide-soignant [13].
La possibilité d’une transmission zoonotique du MPXV a été démontrée de façon spectaculaire en 2003 dans les Etats du Midwest américain [14] lors de l’importation de cricétomes des savanes (Cricetomys gambianus), communément appelés rats de Gambie. Importés du Ghana, ces rats africains d’origine sauvage apparemment sains étaient vendus comme nouveaux animaux de compagnie (NAC) dans des animaleries où ils ont pu contaminer des chiens de prairie (Cynomys ludovicianus), autres rongeurs NAC autochtones de la famille des Sciuridae, qui furent les vecteurs secondaires d’une contamination humaine avec 71 cas, dont plusieurs enfants. Ce fut la seule épidémie importante de variole simienne d’origine zoonotique observée dans un pays non africain.
Rappelons que des rats NAC importés de Hongrie ont causé en Europe en 2009 une autre épidémie, celle-ci due au cowpox, un orthopoxvirus moins pathogène [15].
Du 7 mai 2022 au 30 juin 2022, le nombre des cas humains hors Afrique n’a pas cessé d’augmenter puisque l’on recense 5311 cas dans cinquante-trois pays non africains. En France, 498 cas ont été rapportés, dont une femme et un enfant.
Aspects cliniques
Le tableau clinique de la variole simienne se distingue de celui de la variole humaine par une adénopathie, absente dans la variole. L’éruption cutanée concerne le visage, les mains et différentes parties du corps : papules se transformant en vésicules puis en pustules, qui évoluent vers la cicatrisation avec formation de croûtes et des cicatrices cutanées moins graves que dans la variole humaine.
La variole simienne présente aussi des similitudes avec la varicelle, cette dernière étant toutefois plus contagieuse et causée par un herpèsvirus.
La maladie est généralement bénigne et il n’y a pas eu de mortalité en dehors d’un cas au Nigéria.
Transmissions
Les voies d’exposition potentielles comprennent l’interaction avec des animaux sauvages et la proximité d’individus malades, ainsi que le contact avec l’environnement contaminé.
Transmission zoonotique
Dès 1970, la variole du singe a été considérée comme une maladie virale émergente tout d’abord en RDC où les infections primaires humaines résultent d’un contact avec un animal sylvestre infecté, bien que l’espèce hôte réservoir soit actuellement inconnue.
Il peut s’agir d’un contact avec un animal sauvage devenu familier (rats de Gambie) ou chassé pour être consommé (viande de brousse).
Le seul MPXV isolé d’un mammifère sauvage a été obtenu à partir d’un écureuil à cordes moribond (Funisciurus anerythrus) collecté lors d’une enquête sur une épidémie au RDC [18, 19]. Les animaux les plus fréquemment suspects sont le Cricetomys gambianus (rat de Gambie), le Cercopithecus ascanius (singe à queue rousse) et les écureuils africains, en particulier le genre Funisciurus et Heliosciurus rufobrachium (écureuil soleil à pattes rouges) [16, 20].
Transmission interhumaine
La transmission interhumaine peut être directe, en particulier par le contact cutané (peau à peau), les fluides corporels et les voies respiratoires (gouttelettes). En raison de la grande résistance du virus, tout matériel (vaisselle…) ou linge ayant été en contact avec les croûtes d’un malade est contaminant.
Transmission des cas hors Afrique
Pour les cas inhabituels observés actuellement hors Afrique, les rencontres sexuelles ont joué clairement un rôle dans la transmission [21]. La maladie a surtout été observée chez des homosexuels masculins qui avaient participé à des réunions de leur communauté (fête en Belgique, sauna en Espagne, voyages…).
Moyens de lutte
Il importe évidemment d’éviter tout contact avec la personne atteinte et avec tout ce qu’elle a pu toucher et contaminer.
Les mesures d’éradication ne pourront pas être aussi efficaces avec la variole simienne qu’avec la variole humaine du fait d’un réservoir viral dans plusieurs populations d’animaux sauvages en Afrique.
Conclusion
Agent pathogène réémergent, le virus de la variole du singe semble ne plus se circonscrire aux régions endémiques africaines et le risque est de le voir coloniser mondialement la niche écologique laissée vacante par la variole.
La découverte soudaine de cette maladie hors de l’Afrique chez plus de 5000 personnes depuis le 7 mai 2022, sous une forme très particulière dans près de cinquante pays qui semblaient indemnes, avec un mode de transmission particulier, doit nous amener à une certaine prudence sur l’interprétation de cette émergence.
Cette maladie s’est-elle propagée pendant un certain temps sans être détectée du fait de son évolution bénigne ? Le 25 juin 2022, l’OMS n’envisage pas de déclarer la variole du singe en tant qu’urgence sanitaire mondiale. Mais plus ce virus se propagera longtemps et loin, plus il risque d’être endémique dans de nouvelles régions. Le problème sera de savoir si le MPXV s’établira plus dans un réservoir animal que dans la population humaine s’il continue à se propager.
L’important est de savoir diagnostiquer la variole du singe, d’avertir le public sur le risque de contagiosité de ce virus très résistant dans le milieu extérieur, de la possibilité de zoonose, de surveiller les cas contacts et de prévenir les contaminations des animaux sensibles (NAC exotiques). On peut espérer que la mise en place de ces mesures de biosécurité, associées ou non à une vaccination, limitera toute progression du MPXV en dehors de l’Afrique.
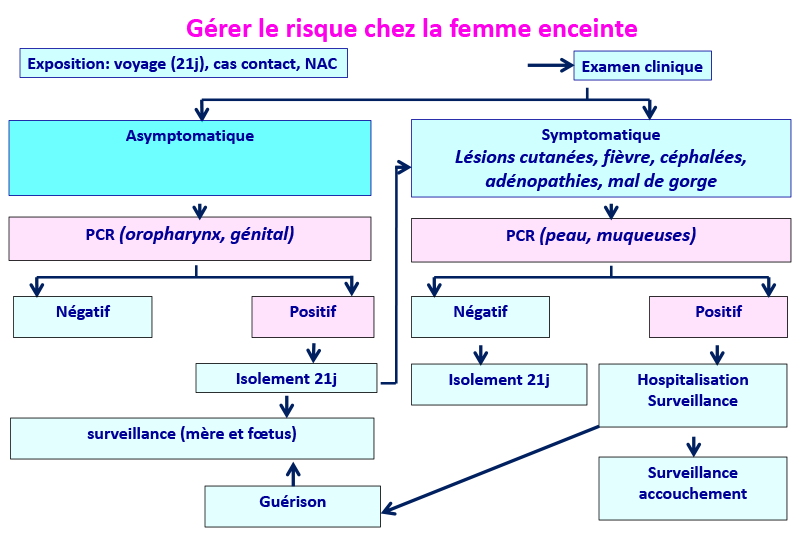
Ce schéma peut s’appliquer aussi à tous les cas d’infection par le MPXV.
(Modifié de www.thelancet.com. Publi. online June 21, 2022)
[1] Magnus P von, Andersen EK, Petersen KB, Birch-Andersen A. A pox-like disease in cynomolgus monkeys. Acta Pathologica Microbiologica Scandinavica. 1959;46(2):156‑76.
[2] Chastel C. Le monkeypox s’épidémise et franchit l’Atlantique (2003). In: Virus émergents. Vers de nouvelles pandémies ?. Vuibert. Adapt. Paris; 2006. 165‑76.
[3] Milhaud C, Klein M, Virat J. Analyse dʼun cas de variole du singe (monkeypox) chez le chimpanzé (Pan troglogdytes). Exp Anim. 1969;2:121‑35.
[4] Bunge EM, Hoet B, Chen L, Lienert F, Weidenthaler H, Baer LR, et al. The changing epidemiology of human monkeypox – A potential threat? A systematic review. Gromowski G, éditeur. PLoS Negl Trop Dis. 11 fév. 2022;16(2):e0010141.
[5] Gomes JP, Isidro J, Borges V, Pinto M, Sobral D, Santos J, et al. Multi-country outbreak of monkeypox virus: phylogenomic characterization and signs of microevolution [Internet]. In Review; 2022 mai [cité 26 juin 2022]. Disponible sur https://www.researchsquare.com/article/rs-1700947/v1
[6] Ladnyj ID, Ziegler P, Kima E. A human infection caused by monkeypox virus in Basankusu Territory, Democratic Republic of the Congo. Bull Org Mond Santé. 1972;46:593‑7.
[7] Durski KN, McCollum AM, Nakazawa Y, Petersen BW, Reynolds MG, Briand S, et al. Emergence of Monkeypox — West and Central Africa, 1970–2017. MMWR Morb Mortal Wkly Rep. 16 mars 2018;67(10):306‑10.
[8] World Health Organization. Disease Outbreak News; Multi-country monkeypox outbreak in non-endemic countries [Internet]. 2022 [cité 22 mai 2022]. Disponible sur https://www.who.int/emergencies/disease-outbreak-news/item/2022-DON385
[9] Brown K, Leggat P. Human Monkeypox: Current State of Knowledge and Implications for the Future. Tropical Med. 20 déc 2016;1(1):8.
[10] Vaughan A, Aarons E, Astbury J, et al. Two cases of monkeypox imported to the United Kingdom, September 2018. Euro Surveill. 2018;pii=1800509.
[11] Erez N, Achdout H, Milrot E, Schwartz Y, Wiener-Well Y, Paran N, et al. Diagnosis of Imported Monkeypox, Israel, 2018. Emerg Infect Dis. mai 2019;25(5):980‑3.
[12] Ng OT, Lee V, Marimuthu K, Vasoo S, Chan G, Lin RTP, et al. A case of imported Monkeypox in Singapore. The Lancet Infectious Diseases. nov 2019;19(11):1166.
[13] Vaughan A, Aarons E, Astbury J, Brooks T, Chand M, Flegg P, et al. Human-to-Human Transmission of Monkeypox Virus, United Kingdom, October 2018. Emerg Infect Dis. avr 2020;26(4):782‑5.
[14] Centers for Disease Control and Prevention (CDC). Update: multistate outbreak of monkeypox – Illinois, Indiana, Kansas, Missouri, Ohio, and Wisconsin, 2003. MMWR Morb Mortal Wkly Rep. 11 juill 2003;52(27):642‑6.
[15] Campe H, Zimmermann P, Glos K, Bayer M, Bergemann H, Dreweck C, et al. Cowpox Virus Transmission from Pet Rats to Humans, Germany. Emerg Infect Dis. mai 2009;15(5):777‑80.
[16] Walker M. Monkeypox Virus Hosts and Transmission Routes: A Systematic Review of a Zoonotic Pathogen. Biological Sciences Undergraduate Honors Theses [Internet]. 1 mai 2022; Disponible sur https://scholarworks.uark.edu/biscuht/69
[17] Alakunle E, Moens U, Nchinda G, Okeke MI. Monkeypox Virus in Nigeria: Infection Biology, Epidemiology, and Evolution. Viruses. 5 nov 2020;12(11):1257.
[18] Reynolds MG, Carroll DS, Olson VA, et al. C. A Silent Enzootic of an Orthopoxvirus in Ghana, West Africa: Evidence for Multi-Species Involvement in the Absence of Widespread Human Disease. The American Journal of Tropical Medicine and Hygiene. 1 avr 2010;82(4):746‑54.
[19] Jezek Z, Grab B, Szczeniowski MV, Paluku KM, Mutombo M. Human monkeypox: secondary attack rates. Bull World Health Organ. 1988;66(4):465‑70.
[20] Monroe BP, Doty JB, Moses C, Ibata S, Reynolds M, Carroll D. Collection and Utilization of Animal Carcasses Associated with zoonotic Disease in Tshuapa District, the Democratic Republic of the Congo, 2012. Journal of Wildlife Diseases. juill 2015;51(3):734‑8.
[21] Endo A, Murayama H, Abbott S, Ratnayake R, Pearson CAB, Edmunds WJ, et al. Heavy-tailed sexual contact networks and the epidemiology of monkeypox outbreak in non-endemic regions, May 2022 [Internet]. Epidemiology; 2022 juin [cité 26 juin 2022]. Disponible sur http://medrxiv.org/lookup/doi/10.1101/2022.06.13.22276353
[22] PRO/AH/EDR> Monkeypox update (01) [Internet]. ProMED-mail. 2022 [cité 21 mai 2022]. Disponible sur https://promedmail.org/
[23] Promed. Monkeypox: Health ministry confirms only one person contracted virus [Internet]. Promed; 2022 [cité 22 mai 2022]. Disponible sur https://www.jpost.com/breaking-news/article-707339

