Jeanne Brugère-Picoux
Professeur honoraire de pathologie médicale du bétail et des animaux de basse-cour (Ecole nationale vétérinaire d’Alfort), membre de l’Académie nationale de médecine, présidente honoraire de l’Académie vétérinaire de France

Introduction
Depuis 2020, les virus du clade 2.3.4.4b de l’influenza aviaire hautement pathogène ou IAHP (H5N1) ont pour origine des virus influenza A (H5Nx) qui se sont propagés principalement via des oiseaux migrateurs dans de nombreuses régions d’Afrique, d’Asie et d’Europe [1]. La persistance inhabituelle de ces virus dans l’avifaune sauvage est à l’origine d’une panzootie désastreuse, comme nous l’avons vu en Europe, notamment en France en 2022, en Amérique du Nord dès février 2022 et en Amérique du Sud à l’automne 2022 [2]. Parallèlement, on a pu observer une augmentation des cas sporadiques de contamination des prédateurs par les oiseaux sauvages infectés et, plus récemment, l’infection d’un élevage de visons en Espagne.
Ces virus IAHP (H5Nx) du clade 2.3.4.4b reconnaissent pour origine le virus asiatique isolé dans le sud de la Chine chez l’oie en 1996 (lignée H5Nx Gs/GD), responsable de l’épizootie qui a provoqué le désastre économique que nous avons connu sur plusieurs continents, notamment en Europe à partir de 2005.
Contaminations de mammifères par le virus de la peste aviaire
Une contamination des mammifères par ce virus asiatique n’est pas une nouveauté car lors de l’épizootie de peste aviaire due à ce virus, une contamination de grands félins avait été notée dans des zoos de Thaïlande en 2004 ou chez le chat dans l’île de Rügen en Allemagne en 2006. Le chat français contaminé récemment représente le premier cas en France et non dans le monde.
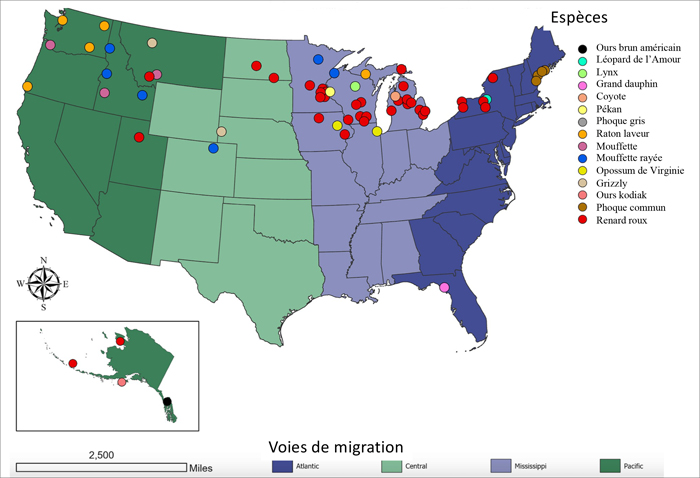
C’est à partir de 2020 que l’on signale des cas sporadiques de contamination avec ce virus asiatique chez des mammifères sauvages, notamment dans des centres de soins : virus IAHP (H5N8) chez de jeunes phoques et un renard roux contaminés par des cygnes au Royaume-Uni [3], puis virus IAHP (H5N1) chez deux jeunes renards roux présentant des signes neurologiques aux Pays-Bas [4]. Les auteurs hollandais avaient alors souligné, dès novembre 2021, la nécessité de faire prendre conscience que les virus du clade 2.3.4.4b de l’IAHP (H5N1) pouvaient se transmettre sporadiquement des oiseaux aux mammifères, avec l’apparition de signes respiratoires ou nerveux, en suggérant que les humains pourraient être aussi concernés [4]. Par la suite, progressivement, les contaminations de mammifères par des virus IAHP (H5Nx) ont été signalées dans différents pays européens et américains entre 2021 et 2023 [1]. Il s’agissait principalement en Europe de phoques, de furets, de loutres, de ratons laveur, de putois, de visons, de blaireaux, de lynx ou de marsouins. Aux États-Unis, de nombreuses espèces ont été atteintes (fig. 1), soit cent-dix cas signalés d’avril 2022 au 6 janvier 2023 [2].
On peut remarquer que les études réalisées sur trois phoques atteints en Allemagne par un virus IAHP (H5N8) ont montré des charges virales surtout importantes dans le tissu cérébral et non dans l’appareil respiratoire, sans transmission à d’autres phoques [5]. Pour les auteurs, la maladie n’était pas contagieuse, l’infection étant probablement la conséquence de l’ingestion d’une eau contaminée, de fèces ou d’oiseaux infectés, avec une atteinte cérébrale par la voie nerveuse (nerf vague) à partir de l’intestin.
L’augmentation de ces contaminations sporadiques de mammifères sauvages par le virus asiatique de la peste aviaire peut s’expliquer par le fait qu’il s’agit de prédateurs ayant ingéré des oiseaux malades ou trouvés morts (ou leur environnement) en raison de la forte expansion du virus dans l’avifaune sauvage sans qu’ils soient contagieux pour leurs congénères. Une surveillance accrue de la faune sauvage peut être aussi une explication supplémentaire.
Cas particulier de l’élevage du vison en Galice
Un rapport d’Eurosurveillance du 19 janvier 2023 décrit l’infection par ce virus asiatique H5N1 clade 2.3.4.4.b dans un élevage de près de 52 000 visons d’Amérique (Neovison vison) en Galice [6]. Au début, ce fut une augmentation rapide du taux de mortalité (0,77%) début octobre 2022 qui alerta les vétérinaires, qui suspectèrent tout d’abord la Covid-19. L’autopsie des animaux atteints a permis de noter une pneumonie hémorragique ou une hépatisation pulmonaire. Deux semaines plus tard, les visons présentèrent un taux de mortalité de 4,3% avec des symptômes neurologiques et un jetage nasal hémorragique. Des prélèvements supplémentaires ont permis de démontrer qu’il s’agissait en fait d’une contamination par le virus de la peste aviaire qui avait sévi dans la sauvagine dans la région avant octobre. Les bâtiments de l’élevage ouverts partiellement ont pu permettre un contact des visons avec des oiseaux infectés (ou leurs fientes), attirés par la nourriture distribuée à base de de poisson ou de poulet. Cependant, à partir des premières cages contaminées, les auteurs ont constaté une contamination ultérieure d’autres cages, laissant supposer une transmission du virus entre les visons. Il s’agirait alors de la première observation d’une transmission inter-espèce du virus de la peste aviaire chez un mammifère. Le séquençage génétique de la souche virale isolée a montré que les animaux ont été infectés par une nouvelle variante du virus IAHP (H5N1) qui comprend le matériel génétique d’une souche trouvée chez les goélands, ainsi qu’un changement génétique [mutation (T271A) sur PB2] connu pour augmenter la capacité de certains virus influenza à se reproduire chez les mammifères.
C’est pourquoi, très rapidement, les autorités espagnoles ont décidé d’euthanasier l’ensemble des visons et de mettre en place les mesures de biosécurité pour éviter tout risque de diffusion éventuelle de ce virus aviaire à l’Homme. Il faut cependant noter que les onze membres du personnel de l’élevage en contact avec les visons se sont tous révélés négatifs, peut-être en raison du port du masque obligatoire depuis les cas de Covid-19 observés dans les élevages de vison.
Risque pour l’Homme du clade 2.3.4.4b
L’épidémie de peste aviaire liée au clade 2.3.4.4.b dans l’élevage de visons a suscité une certaine inquiétude concernant un risque éventuel pour l’Homme [7]. On connaissait la notification à l’OMS de six cas humains de grippe A (H5N1) appartenant à ce clade en Chine (un cas), en Espagne (deux cas), au Royaume-Uni (un cas) et au Vietnam (un cas), qui ont justifié une analyse de risque pour la santé humaine [8]. En fait, les quatre cas européens se sont révélés asymptomatiques ou bénins par comparaison avec les deux cas asiatiques, dont le cas chinois qui s’est révélé mortel. Tous ces cas étaient liés à des interventions dans des élevages atteints de peste aviaire ou des contacts avec des volailles vivantes (marchés, basse-cour).
Conclusion
En conclusion, les détections actuelles des virus IAHP (H5Nx) clade 2.3.4.4b chez des oiseaux sauvages, des volailles, des mammifères sauvages ou l’élevage de visons espagnols ne modifient pas le risque pour la santé du grand public, que l’on peut considérer comme très faible du fait d’une barrière d’espèce importante entre l’Homme et les volailles. Une vaccination contre la grippe humaine des personnes travaillant dans les élevages porcins et aviaires peut être recommandée.
Par mesure de précaution, la surveillance des élevages porcins peut être aussi recommandée. Lors de l’épizootie en Europe du virus IAHP (H5N8) clade 2.3.4.4b pendant l’automne-hiver 2016-2017, une surveillance renforcée a été réalisée dans des élevages mixtes porcins-volailles en France [9]. Seul un porc proche d’un élevage de canards s’est révélé séropositif sans avoir présenté de signes cliniques, comme dans le cas des contaminations humaines.
Mais il convient d’être vigilant pour surveiller l’évolution de ces virus de la peste aviaire et leur potentiel zoonotique éventuel du fait d’éventuelles mutations ou réassortiments, même si l’hypothèse d’une pandémie liée à un tel virus est heureusement loin d’être démontrée. Cette surveillance à l’interface animal/Homme des cas de grippe zoonotique est recommandée par l’OMS et l’ECDC, Santé publique France, l’Anses et le CNR Virus des infections respiratoires. Si, actuellement, la surveillance des grippes zoonotiques en France est essentiellement passive, une réflexion est en cours pour mettre en place un dispositif de surveillance active des professionnels exposés aux foyers d’IAHP comme plusieurs pays l’ont mis en place depuis 2021 (ou sont en train de le mettre en place).
Nous assistons surtout actuellement à une panzootie touchant gravement la filière avicole et les oiseaux sauvages, l’atteinte explosive actuelle de ces derniers expliquant d’une part les contaminations possibles de leurs prédateurs sauvages (sans contagiosité ultérieure dans ces espèces) et d’autre part les difficultés rencontrées pour limiter l’extension de cette virose.
[1] European Food Safety Authority, European Centre for Disease Prevention and Control, European Union Reference Laboratory for Avian Influenza, Adlhoch C, Fusaro A, Gonzales JL, Kuiken T, Marangon S, et al. Avian influenza overview September-December 2022. EFSA [Internet]. janv 2023 [cité 31 janv 2023];21(1). Disponible sur: https://data.europa.eu/doi/10.2903/j.efsa.2023.7786
[2] Schnirring Lisa. USDA reports more H5N1 avian flu in mammals, including bears. CIDRAP-University of Minnesota; 2023.
[3] Floyd T, Banyard AC, Lean FZX, Byrne AMP, Fullick E, Whittard E, et al. Encephalitis and Death in Wild Mammals at a Rehabilitation Center after Infection with Highly Pathogenic Avian Influenza A(H5N8) Virus, United Kingdom. Emerg Infect Dis. nov 2021;27(11):2856‑63.
[4] Rijks JM, Hesselink H, Lollinga P, Wesselman R, Prins P, Weesendorp E, et al. Highly Pathogenic Avian Influenza A(H5N1) Virus in Wild Red Foxes, the Netherlands, 2021. Emerg Infect Dis. nov 2021;27(11):2960‑2.
[5] Bordes L, Vreman S, Heutink R, Roose M, Venema S, Pritz-Verschuren SBE, et al. Highly Pathogenic Avian Influenza H5N1 Virus Infections in Wild Red Foxes (Vulpes vulpes) Show Neurotropism and Adaptive Virus Mutations. Richard M, éditeur. Microbiol Spectr. 23 janv 2023;e02867-22.
[6] Agüero M, Monne I, Sánchez A, Zecchin B, Fusaro A, Ruano MJ, et al. Highly pathogenic avian influenza A(H5N1) virus infection in farmed minks, Spain, October 2022. Eurosurveillance [Internet]. 19 janv 2023 [cité 31 janv 2023];28(3). Disponible sur: https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2023.28.3.2300001.
[7] Sidik SM. Bird flu outbreak in mink sparks concern about spread in people. Nature. 2 févr 2023;614(7946):17‑17.
[8] OMS. Assessment of risk associated with recent influenza A(H5N1) clade 2.3.4.4b viruses. OMS; 2022.
[9] Hervé S, Schmitz A, Briand FX, Gorin S, Quéguiner S, Niqueux É, et al. Serological Evidence of Backyard Pig Exposure to Highly Pathogenic Avian Influenza H5N8 Virus during 2016–2017 Epizootic in France. Pathogens. 18 mai 2021;10(5):621.

